LONZA Amaxa 4D-Nucleofector细胞核转染系统
在生命科学研究中,将DNA、RNA或蛋白质引入细胞,以改变其基因型或表型的过程被称为转染,在各类研究中十分重要。传统的电穿孔是一种物理转染方法,通过对细胞施加电脉冲,改变细胞膜的通透性,并通过电场将外源分子移动到细胞中。电穿孔技术是细胞系中转染大型DN段的强大工具,但其高细胞毒性、转染原代细胞和干细胞的低效率,限制了其广泛应用。
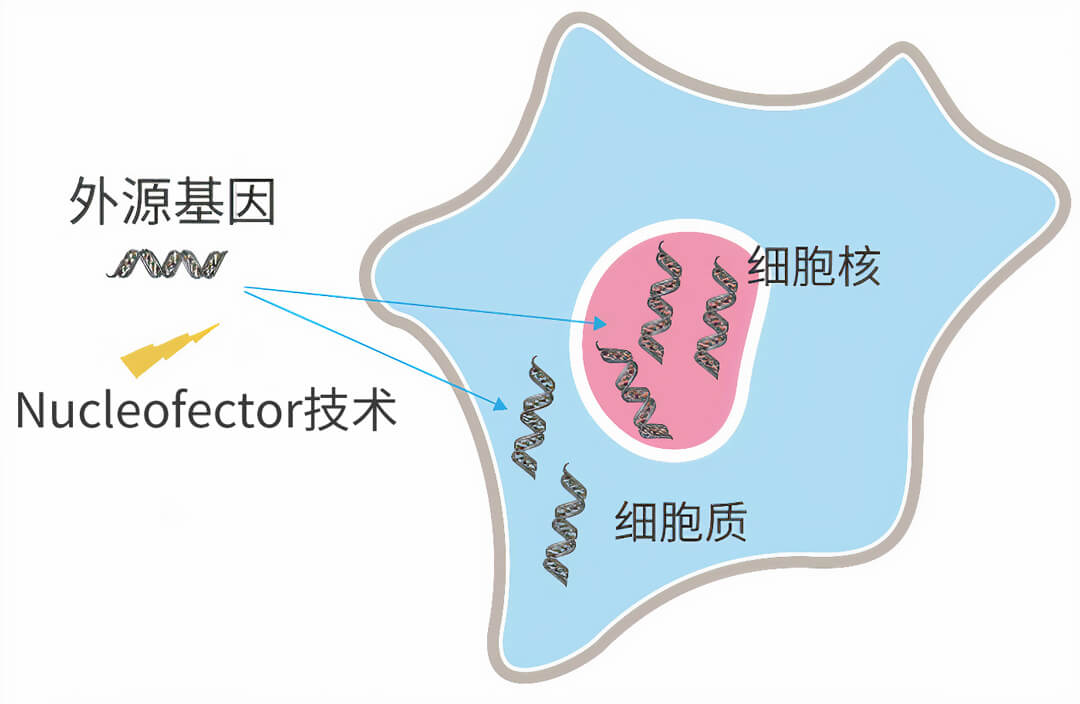
LONZA 4D-Nucleofector(原Amaxa 4D-Nucleofector)细胞核转染系统,创新性地结合经典电穿孔技术和细胞特异性电转染液,实现了DNA、RNA、小分子物质高效转染各类哺乳动物贴壁细胞和悬浮细胞。
LONZA 4D-Nucleofector技术不依赖于细胞有丝,不受细胞增殖的影响,可直接将外源基因导入细胞核中,即使是未的原代细胞(如静止的T淋巴细胞或神经元),也可以快速表达。
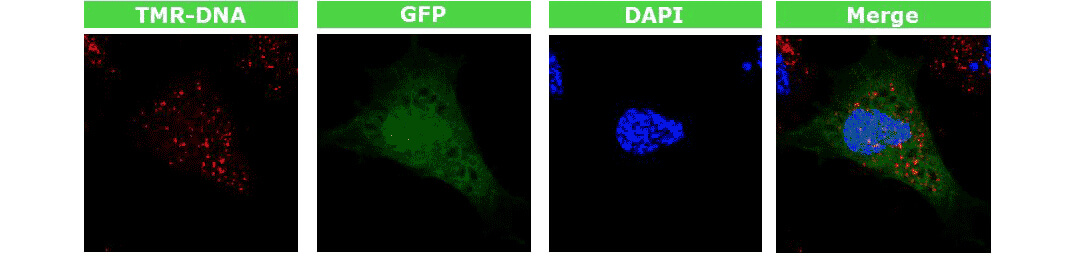
图. GFP标记的质粒转染新生儿皮肤成纤维细胞,2小时后用3.5% PFA 固定,共聚焦显微镜可观察到GFP蛋白在细胞核内表达。
LONZA Nucleofector对质粒DNA转染效率高达90%,寡核苷酸(如siRNA)转染效率高达99%,面世20年来,已成功转染>1200种细胞系、>130种原代细胞,并在干细胞、免疫细胞、神经细胞等各类较难转染的细胞中获得了优秀的转染效果。
4D-Nucleofector细胞核转染特点
1.针对每种细胞优化的电脉冲参数,可将底物导入细胞质甚至是细胞核;
2.特殊配方的电转染液,同时提供高转染效率和细胞保护,提高细胞转染后存活率;
3.全程实验指导,从细胞来源、传代、培养条件、培养基、到转染后的培养技巧,已形成成熟的实验方案。
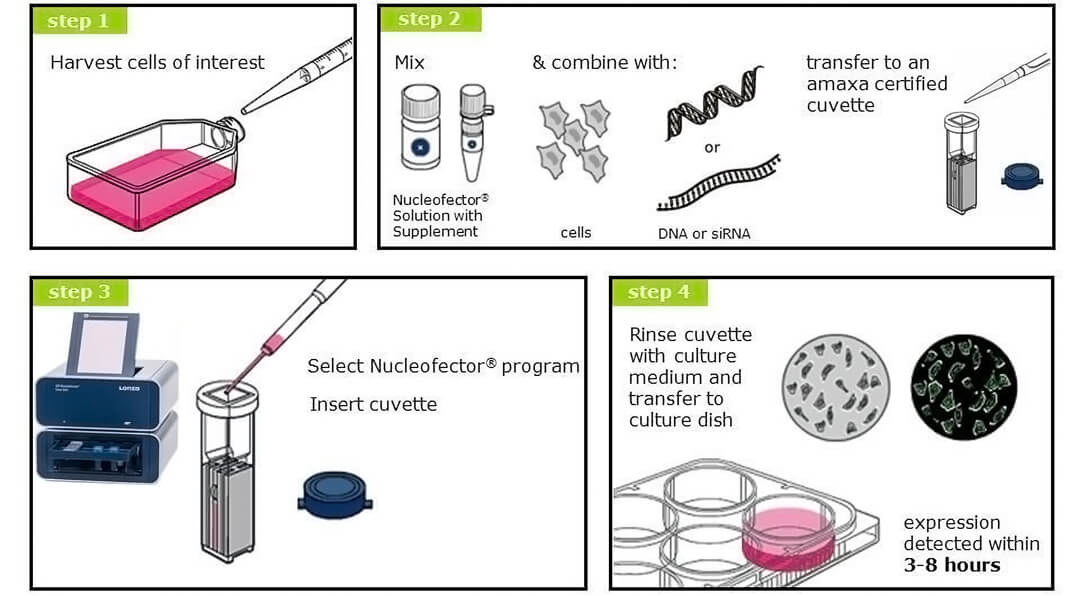
4D-Nucleofector核转染系统为基因治疗研究、免疫治疗研究、干细胞研究等提供了方便的工具。相比电穿孔在内的其他非病毒转染技术,更具优势:
-采用高分子聚合物电极,避免传统铝电极的离子毒害,维持细胞生理状态,提高存活率。
-转染后可快速观察实验结果,例如转染GFP后最快2小时可观察到蛋白。
-无需自己优化条件,拥有超过650种细胞类型的现成程序,可直接使用,全球共享数据库,超过1500条转染数据可供参考。
-可转染包括DNA、mRNA、miRNA、siRNA、肽、蛋白质在内的多种底物。
-可用于难以转染的原代细胞、干细胞、神经元、细胞系。
-可不用消化细胞,进行贴壁细胞的原位转染。
-灵活的转染规模缩放,可在低、中、高通量中轻松转移,实现2×10^4至1×10^9个细胞数量的轻松扩展。
-已在全球8000多家同行评议的出版物中发表。
最近,LONZA 4D-Nucleofector核转染系统已广泛应用于通过RNAi、CRISPR进行的基因编辑研究、以及iPS诱导多能干细胞、CAR-T的研究中,在包括功能和结构基因组学、药物发现以及基因和细胞疗法的研究中大放异彩。
LONZA 4D-Nucleofector细胞核转染系统参数
| 品牌 |
LONZA龙沙 |
| 产地 |
德国科隆 |
| 名称 |
4D-Nucleofector细胞核转染系统 |
| 型号 |
4D |
| 货号 |
AAF-1002B |
Core模块,简称C模块 |
| |
AAF-1002X |
X模块 |
| |
AAF-1002Y |
Y模块 |
| |
AAF-1002L |
LV模块 |
| |
AAM-1001S |
96孔模块 |
| 用途 |
用于干细胞、原代细胞、细胞系的高效转染 |
| 适用细胞 |
贴壁细胞、悬浮细胞,包括难转染的血液系统细胞和干细胞 |
| 转染物 |
质粒、RNA、蛋白质、小分子化合物等 |
4D-Nucleofector细胞核转染系统采用模块化设计,可根据研究者的需求,自行组合数个模块形成一套完整系统。
常用模块组合参考:
常规小规模转染:C+X
贴壁细胞原位转染:C+Y
悬浮+贴壁细胞转染:C+X+Y
大规模转染:C+X+LV
摸索复杂转染条件:C+X+96孔
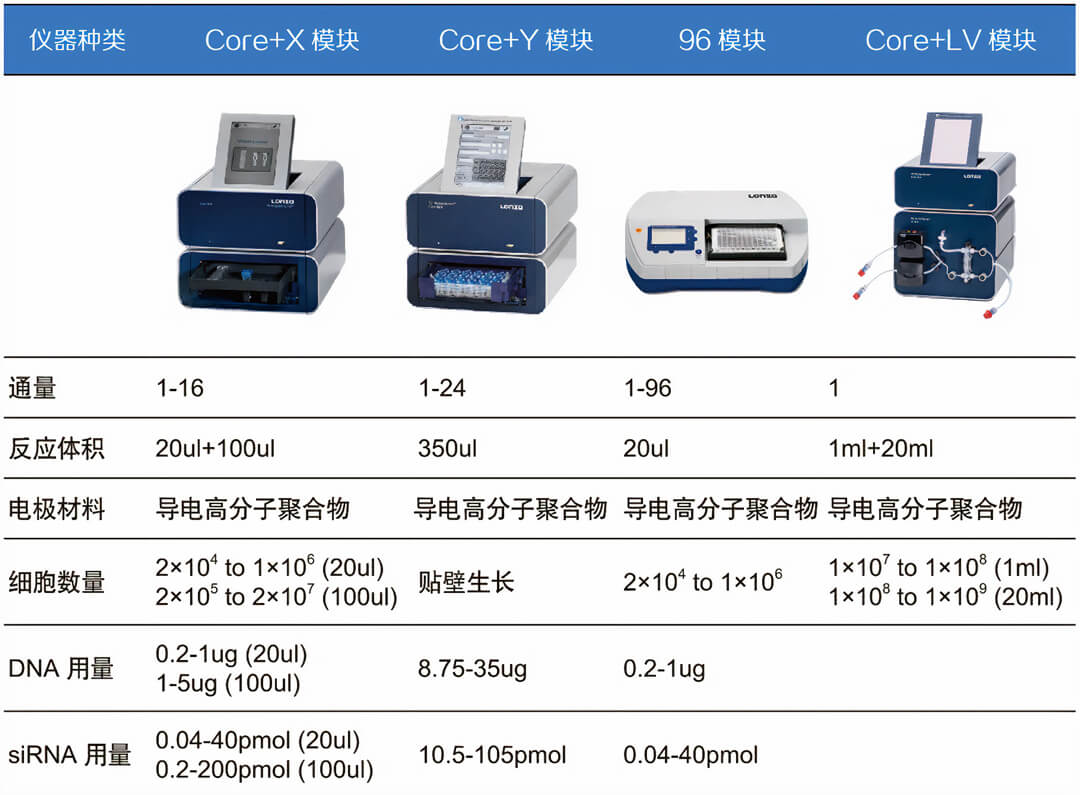
各模块功能和应用:
1、C模块:4D-Nucleofector系统的控制单元,内置转染程序,将不同的功能单元(模块)整合为一个系统,以运行不同的应用程序。

2、X模块:用于悬浮细胞、或贴壁细胞消化后的小规模转染,转染细胞数量2×10^4至2×10^7。可同时转染2个100μL电转杯、1个16孔电转板条(每孔20μL),每个电转杯、每个孔可独立设置程序。另外在使用96孔模块时,也需要X模块。

3、Y模块:用于贴壁细胞不经消化的原位转染,可同时转染1个24孔电转板条(每孔350μL),每个孔可独立设置程序。

4、LV模块:用于同一种悬浮细胞、或同一种贴壁细胞消化后的大规模转染,转染细胞数量1×10^7至1×10^9。可使用1mL手动进样电转盘、或20mL连续进样电转盘。通常使用X模块小试摸条件,再用LV模块线性放大转染规模。

5、96孔模块:用于同时转染96个样品的细胞,转染细胞数量2×10^4至1×10^6。每个孔可独立设置程序。必须与X模块结合使用。

参考文献:
1.Engineering of CRISPR-Cas12b for human genome editing.Strecker J, et al. Nature (2019) 10(1): 212
2.Gene correction for SCID-X1 in long-term hematopoietic stem cells.Pavel-Dinu M, et al. Nat Commun. (2019) 10 (1): 1634
3.Orthotopic replacement of T-cell receptor a- and ?-chains with preservation of near-physiological T-cell function.Schober K, et al. Nat Biomed Eng (2019) 10: 01
4.Ribonucleoprotein Transfection for CRISPR/Cas9-Mediated Gene Knockout in Primary T Cells.Oh SA, et al. Curr Protoc Immunol (2019) 124(1): e69
5.Polymer-stabilized Cas9 nanoparticles and modified repair templates increase genome editing efficiency.Nguyen DN, et al. Nat Biotechnol (2019) 1: 1
6.CRISPR-Cas9 genome engineering of primary CD4+ T cells for the interrogation of HIV-host factor interactions. Hultquist JF, et al. Nat Protocols (2019) 14(1): 1-27
7.Bacteria-free minicircle DNA system to generate integration-free CAR-T cells.Chen Cheng, et al. J Med Genetics (2019) 56: 10–17
8.Genome-wide CRISPR Screens in Primary Human T Cells Reveal Key Regulators of Immune Function. Shifrut E, et al. Cell (2018) 175(7): 1985-1971
9.Guide Swap enables genome-scale pooled CRISPR-Cas9 screening in human primary cells. Ting PY, et al. Nat Methods (2018) 15(11)
10.Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity.Castiglia S,et al.J Transl Med (2018) 16: 237
11.A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Vakulskas CA,et al.Nat Med (2018) 24(8): 1216-1224
12.Reprogramming human T cell function and specificity with non-viral genome targeting.Roth TL,et al.Nature (2018) 559: 405-9
13.Nucleofection with Plasmid DNA for CRISPR/Cas9-Mediated Inactivation of Programmed Cell Death Protein 1 in CD133-Specific CAR T Cells.Hu B,et al.Hum Gene Ther (2018)
14.Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells.Seki A,et al.J Exp Med (2018) 215(3): 985-997
15.Improved Expansion and In Vivo Function of Patient T Cells by a Serum-free Medium.Medvec AR,et al.Mol Ther Methods Clin Dev. (2017) 7; 8: 65-74
16.Going non-viral: the Sleeping Beauty transposon system breaks on through to the clinical side.Hudecek M1,et al.Clin Exp Immunol (2017) 52(4): 355(80)
17.CRISPR-Mediated Integration of Large Gene Cassettes Using AAV Donor Vectors.Bak RO,et al.Cell Rep (2017) 20(3): 750-756
18.CRISPR-Cas9 mediated LAG-3 disruption in CAR-T cells.Zhang Y,et al.Frontiers in Immunology (2017) 1: 1-9
19.CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells.Rupp LJ1,et al.Scientific Reports (2017) 7 (1): 737
20.A genome-wide CRISPR screen identifies a restricted set of HIV host dependency factors.Park RJ, et al.Nat Genet (2017) 49(2): 193-203
点击右侧在线咨询,免费咨询4D-Nucleofector核转染系统技术问题+获取报价+申请试用
——LONZA中国一级代理商,北京泽平